Таблетки, содержащие Lactobacillus reuteri, подавляют инфекцию Helicobacter pylori
Двойное слепое рандомизированное плацебо-контролируемое перекрестное клиническое исследование
Kyoto IMASE, Akifumi TANAKA, Kengo TOKUNAGA, Hajime SUGANO, Hitoshi ISHIDA
& Shin\’ichi TAKAHASHI
Третье отделение внутренних болезней, Медицинская школа Университета Киорин
(Получено: 16 октября, 2006 г.)
(Согласовано: 20 марта, 2007 г.)
Ключевые слова: Helicobacter pylori, пробиотики, Lactobacillus reuteri, рандомизированное контролируемое исследование
Тезисы
Нами было изучено влияние Lactobacillus reuteri штамма SD2112 в виде таблеток Reuterina (производитель ERINA Co., Inc.) на подавление уреазной активности H. pylori, а также применение уреазного дыхательного теста (УДТ) как маркера тяжести инфекции. Метод 1: Оценка УДТ и степени обсемененности H. pylori. Группу субъектов исследования составили 33 пациента с положительным результатом обследования на H. pylori, которым проводилась эндоскопия верхних отделов ЖКТ с биопсией желудка. Была изучена корреляционная взаимосвязь между результатами УДТ и наличием H. pylori. Каждому пациенту УДТ проводился индивидуально. По степени обсемененности H. pylori пациенты были разделены на 3 группы: Группа 1 (слабая обсемененность), Группа II (средняя обсемененность) и Группа III (сильная обсемененность). Затем проводилась оценка корреляции между результатами индивидуальных УДТ и выявленным количеством H. pylori. Метод 2: Оценка супрессивного влияния L. reuteri на уреазную активность H. pylori. Группу субъектов исследования составили 40 добровольцев с бессимптомным течением инфекции, у которых результат УДТ превышал 15‰. Они были рандомизированы в 4 группы: Субъекты из Группы А прошли активное лечение в течение 4 недель (период 1), а затем в последующие 4 недели получали плацебо (период 2). Субъекты из Группы В прошли лечение в обратном порядке. Субъекты из Группы С получали плацебо. Группу D составили добровольцы с отрицательными результатами УДТ, которые получали активное лечение в течение 8 недель. Результат 1: Результаты УДТ составили 11,6±2,0‰, 22,1±2,6‰ и 35,4±7,6‰ в Группах I, II и III, что указывает на существенное увеличение значений УДТ (Группа I по сравнению с Группой II: p<0,01 и I по сравнению с III: p<0,05) в соответствии с обсемененностью H. pylori. Результат 2: В Группах А и В были получены существенные различия в уменьшении результатов УДТ до и после лечения. В Группе А более низкие значения УДТ сохранялись до конца всего 8-недельного периода лечения. В целом, уменьшение результатов УДТ на фоне применение таблеток с L. reuteri составило 69,7±4,0% (p<0,05). Заключение: Применение таблеток, содержащих L. reuteri [Reuterina (ERINA Co.,Inc.)], существенное уменьшает результаты УДТ у субъектов с положительным анализом на H. pylori, что указывает на способность L. reuteri подавлять уреазную активность и уменьшать обсемененность H. pylori.
[JJ.A. Inf. D. 81:387-393, 2007]
Введение
Общепризнанно, что Helicobacter pylori повреждают слизистую оболочку желудка. Терапией первого выбора при ведении пептической язвы с положительным результатом анализа на H. pylori является эрадикация микроорганизма, однако у 10-20% пациентов она не дает положительного результата1-5. Уменьшение эффективности эрадикации за счет увеличения лекарственной устойчивости H. pylori стало общемировой проблемой. Не существует какой-либо установленной лечебной схемы при рефрактерных к терапии случаях, то есть при неэффективности эрадикации H. Pylori. У большого числа лиц, инфицированных H. Pylori, проявления инфекции отсутствуют, а поэтому нет необходимости в проведении эрадикации. Тем не менее, при сохранении инфекции данных «здоровых» лиц следует рассматривать как группу риска развития заболевания6. Все больше внимания привлекают пробиотические препараты, которые разработаны для улучшения состояния нарушенной микрофлоры, свойственной кишечнику. Сообщается, что молочнокислые бактерии подавляют развитие хеликобактер-ассоциированного гастрита за счет уменьшения обсемененности H. pylori. Нами было изучено влияние одного из подобных пробиотиков, Lactobacillus reuteri штамма SD2112 в таблетках [L. reuteri в таблетках, Reuterina (производство ERINA Co., Inc.)], на подавление уреазной активности H. pylori и возможности использования уреазного дыхательного теста (УДТ) как маркера выраженности инфицирования.
Материалы и методы
1. Оценка результатов УДТ
УДТ использовался для диагностики хеликобактерной инфекции. Добровольцы были проинструктированы принять внутрь препарат мочевины, меченной 13C (Таблетки UBIT 100 мг, производства компании Otsuka Pharmaceutical Co., Ltd., Токио, Япония). Препарат следовало принимать натощак, рано утром, в сидячем положении, предварительно растворив в 100 мл воды. Забор образцов выдыхаемого воздуха осуществлялся до и спустя 20 минут после перорального приема препарата; затем проводился УДТ с определением количества 13C (тест-система UbiT-IR300; производства компании Otsuka Electronics Co., Ltd., Осака, Япония). Для расчета количества 13C использовалась следующая формула: A13C = S13C (после приема таблеток UBIT) — S13C(перед приемом таблеток UBIT). Пороговое значение для УДТ определялось как 2,5% (на основании результатов широкомасштабных проспективных клинических исследований в Японии7). Результат УДТ более 2,5% рассматривался как положительный. В других работах8 было показано, что воспроизводимость УДТ увеличивается со временем. Детальное изучение данных отчетов выявило тенденцию к неточности УДТ при результатах, равных или больших 50‰. В другом отчете9 были показаны существенные различия в уреазной активности, не обязательно связанные с техническими причинами при проведении теста, несмотря на то, что тенденция к нестабильности результатов появлялась при высокой уреазной активности. На основании данных отчетов мы изучили результаты УДТ за 8 недель до назначения препарата и вычислили стандартное значение УДТ, которое сравнивалось со значением теста непосредственно до приема препарата. Субъекты, у которых разница между стандартным значением УДТ и значением до приема препарата превышало 50‰, исключались из текущего анализа в силу небольшой достоверности результатов.
2. Взаимосвязь между результатами УДТ и обсемененностью H. pylori.
Было получено информированное согласие от 33 пациентов с положительным результатом обследования на H. Pylori (возраст 28-63 года; средний возраст 49,2±9,90 лет; 30 мужчин и 3 женщины), которые прошли эндоскопическое обследование верхних отделов ЖКТ в Университетской больнице Киорин. У каждого пациента были получены биоптаты слизистой желудка и проведен индивидуальный УДТ. Забор биоптатов производился из двух участков большой кривизны желудка, из антрального отдела и верхней части тела. Каждый образец сразу же погружался в контейнер Seed Tube HP (производства Eiken Chemical, Токио, Япония) и хранился при температуре 4°C. Каждый образец биоптата помещался в забуференный пептонный раствор с хлоридом натрия объемом 1 мл (производства Nissui, Токио, Япония) и выращивался в течение 5-7 дней на среде Skirrow (производства Kyokuto Pharmaceutical Industrial Co. Ltd., Токио, Япония) при температуре 370С в микроаэробных условиях (5% O2, 10% CO2, 85% N2). Количество H. pylori выражалось, как это описано в других источниках10. Далее изучалась взаимосвязь между результатами УДТ и бактериальной обсемененностью. По степени обсемененности H. pylori пациенты были разделены на 3 группы: Группа I (менее 1×105 колониеобразующих единиц (КОЕ)/мл), Группа II (от 1×105 до 5×105 КОЕ/мл) и Группа III (более 5×105 КОЕ/мл). Пациенты в данных группах были сопоставимы по возрасту, полу и заболеванию. Затем выявлялась корреляция между результатами индивидуальных УДТ и установленной обсемененностью H. pylori.
3. Оценка супрессивного влияния L. reuteri на уреазную активность H. pylori.
Было получено информированное согласие от 179 добровольцев, у которых отсутствовали симптомы заболевания (возраст: 18-65 лет, средний возраст 44,5±10,5 лет; 84 мужчины и 95 женщин). Из 40 участвовавших в исследовании добровольцев H. pylori были выявлены у 35 человек (средний возраст 47,8±10,7 лет; 19 мужчин и 21 женщина), тогда как у 5 человек результаты теста были отрицательными. УДТ проводился четыре раза: за 8 недель до начала исследования, непосредственно перед применением препарата, 4 и 8 недель спустя. Добровольцы, у которых результаты УДТ превышали 15%, были рандомизированы в одну из групп: А, В или С. Группа А (n = 15, средний возраст 48,1±13,5 лет) и Группа В (n = 15, 48,9±7,05 лет) вошли в рандомизированное двойное слепое перекрестное исследование, в котором действие таблеток, содержащих L. reuteri (активный ингредиент: 108 КОЕ L. reuteri штамма ATCC 55730), сравнивалось с действием идентичного плацебо. Плацебо-таблетки не содержали L. reuteri, а количество изомальта в них было несколько выше для компенсации веса. Суточная доза составляла 4 таблетки. Субъекты из Группы А прошли активное лечение в течение 4-х недель (период 1), а в последующие 4 недели получали плацебо (период 2). Субъекты из Группы В получали лечение в обратном порядке, то есть плацебо в течение 4-х недель (Период 1), а затем в последующие 4 недели — L. reuteri в таблетках (Период 2).
Субъекты из Группы С (n = 5, средний возраст 48,8±11,6 лет) также принимали участие в рандомизированном двойном слепом исследовании, но получали плацебо в течение полных 8 недель. Цель участия этой группы заключалась в оценке естественной интраиндивидуальной изменчивости результатов УДТ во времени. Для измерения истинной изменчивости УДТ первоначальные значения теста должны были соответствовать 15‰ или более. Группа D (n = 5, средний возраст 42,6±9,39 лет) состояла из добровольцев с отрицательным результатом УДТ, которые в течение всех 8 недель ежедневно получали по 4 таблетки, содержащие L. reuteri. Данная группа участвовала в исследовании для получения доказательств того, что L. reuteri не влияет непосредственно на результаты УДТ. К критериям исключения относились хронические заболевания, пероральный прием таких препаратов, как антациды и антибиотики; употребление йогуртов и участие в других клинических исследованиях в предшествующие 4 недели.
Рисунок 1 Корреляция между результатами УДТ и обсемененностью H.pylori
*p< 0,05 (критерий знаковых рангов Уилкоксона

4.Анализ
Все полученные данные выражались через стандартную ошибку среднего (СОС). Выраженность различий между группами анализировалась с помощью критерия Уилкоксона с использованием программы Stat view версии 5.0 для компьютеров Macintosh. Протокол исследования был представлен Этическому комитету Университета Киорин для рассмотрения и одобрения.
Результаты
1. УДТ и обсемененность H. pylori
Как показано на Рисунке 1, результаты УДТ составили 11,6±2,0‰ (среднее значение±СОС), 22,1±2,6‰ и 35,4±7,6‰ в Группах I (слабая обсемененность: 0,4×105±0,1×105 КОЕ/мл), II (средняя обсемененность: 2,5×105±0,4×105 КОЕ/мл) и III (сильная обсемененность: 8,8×105±0,7×105 КОЕ/мл), что указывает на существенное увеличение результатов УДТ (Группа I по сравнению с Группой II:p<0,01 Группа I по сравнению с Группой III:p< 0,05) при увеличении обсемененности.
2. Супрессивное влияние таблеток, содержащих L. reuteri на H. pylori.
(a) Вариации результатов УДТ
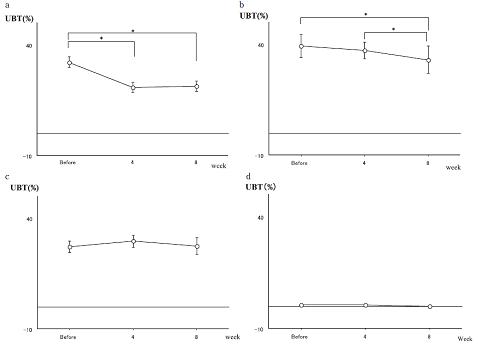
Как показано на Рисунках 2а-2d, были выявлены существенные различия (p<0,05) в уменьшении результатов УДТ, проведенного в Группе А (n = 13) перед и спустя 4 недели лечения, а также в Группе В (n = 11) перед и спустя 8 недель лечения, тогда как в Группах С (n = 5) и D (n = 5) подобные различия не отмечались.
(b) Уменьшение результатов УДТ
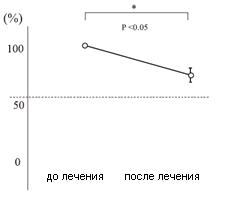
Уменьшение результатов УДТ было изучено на 24 субъектах из Групп А и В в период приема ими таблеток, содержащих L. reuteri (6 субъектов были дисквалифицированы и исключены из исследования). Уменьшение результатов УДТ оценивалось на основании значений теста перед и спустя 4 недели лечения в Группе А, а также перед и спустя 8 недель лечения в Группе В. При сравнении с результатами теста до лечения, в Группе А значения УДТ изменились на 65,3±5,8% спустя 4 недели лечения (p<0,05) и в Группе В — на 74,9±5,2% спустя 8 недель лечения (p<0,05), то есть значения УДТ изменились существенно. В Группах С и D подобные существенные различия выявлены не были. На Рисунке 3 показаны различия результатов УДТ в период перорального приема субъектами из Групп А и В таблеток, содержащих L. reuteri. В целом, уменьшение результатов УДТ на фоне приема таблеток, содержащих L. reuteri, за весь период лечения составило 69,7±4,0% (p<0,05), то есть было значительным.
(c) Число лиц, ответивших на лечение.
В итоге, на лечение таблетками, содержащими L. reuteri, положительно ответили 19 субъектов из 24, тогда как на плацебо ответ был получен только у 10 человек (p<0,01, точный критерий Фишера). Следует отметить, что 7 субъектов из 10, ответивших положительно на плацебо, принадлежали к Группе А, что указывает на возможность «позднего» ответа на L. reuteri.
Рисунок 2. Изменения результатов УДТ в Группе А(а), В (b), C(c) и D(d). Результаты УДТ на фоне лечения различались в Группе А и В. Для Группы А (n = 13) значения УДТ показаны до и спустя 4 недели после лечения. Для Группы В (n=ll) значения УДТ показаны до и спустя 8 недели после лечения. Группа С (n = 5) и Группа D (n =5).
Обсуждение
Существуют доводы за и против наличия корреляции между обсемененностью H. pylori и результатами УДТ. В некоторых отчетах11-12 указывается на существенную взаимосвязь между подтвержденной гистологически обсемененностью H. pylori и УДТ, тогда как другие данные9 говорят об отсутствии корреляции между этими явлениями. Мы сравнили возможную корреляцию между обсемененностью H. pylori и результатами УДТ в трех группах с различной обсемененностью: слабой, средней и сильной. Как показано на Рисунке 1, между тремя группами были выявлены существенные различия в результатах УДТ, что позволяет предположить наличие взаимосвязи между бактериальной обсемененностью и УДТ. Если говорить об этиологии повреждения слизистой оболочки желудка, то в некоторых отчетах13-14 указывается на выработку бактериями H. pylori аммиака за счет уреазной активности. Возникающий при этом обратный ток ионов водорода вызывает повреждение слизистой. В другом отчете9 обсуждается корреляция между уреазной активностью H. pylori и степенью выраженности гастрита, тогда как в другой работе15 указывается на пригодность УДТ для оценки обсемененности и активности H. pylori и тяжести гастрита. Мы выявили выраженную взаимосвязь между обсемененностью H. pylori и степенью выраженности гастрита10. При увеличении обсемененности H. pylori предположительно увеличивается и количество патогенных веществ, которые вызывают повреждение слизистой оболочки желудка.
Рисунок 3. Уменьшение результатов УДТ от начала лечения перорального лечения таблетками, содержащими L. reuteri, до его завершения у всех пациентов (n=24)
Употребление пробиотиков как пищевых добавок, а также с целью улучшения здоровья и лечения заболеваний пищеварительной системы все больше увеличивается16-17. Сообщается, что штамм Lactobacillus gasseri OLL 2716 (LG21), пробиотик, уменьшает результаты УДТ, соотношение пепсиногена 1 и 2 и титр сывороточных антител к H. pylori у пациентов с положительным анализом на H. pylori18. Предполагается, что LG21 уменьшают обсемененность H. pylori. Нами был использован УДТ для оценки супрессивного влияния L. reuteri на H. pylori в организме здоровых добровольцев. Как показано на Рисунке 2а, назначение таблеток, содержащих L. reuteri, в Группе А привело к существенному уменьшению результатов УДТ в конце первого 4-хнедельнего периода. Низкие значения УДТ сохранялись до конца всего 8-недельного периода лечения, во время второй половины которого субъекты получали плацебо. В Группе В в период лечения L. reuteri результаты УДТ также уменьшились (Рисунок 2b). В некоторых отчетах19-20 было показано, что штамм Lactobacillus johnsonii La1, вводимый мышам, выживал в кишечнике в течение длительного времени, даже после прекращения лечения, что соответствует полученным нами результатам. В настоящем исследовании было выявлено, что L. reuteri способны к продолжительной жизни в желудке и кишечнике21, даже после прекращения приема таблеток, содержащих L. reuteri.
Известно, что L. reuteri, типичные кишечные бактерии у позвоночных, являются непатогенными и очень безопасными. Сообщается, что они вырабатывает антибиотикоподобное вещество и способны к адгезии в пищеварительном тракте, что подавляет фиксацию патогенных бактерий к слизистой оболочке22. Данное антибиотикоподобное вещество носит название реутерин (3-гидроксипропионовый альдегид) и вырабатывается анаэробными микроорганизмами в присутствии глицерола23 Согласно одному из отчетов24, данное вещество обладает широким спектром противомикробного действия, включая грамположительные, грамотрицательные бактерии, дрожжи и другие грибки. Сообщается25, что L. reuteri подавляет фиксацию H. pylori к слизистой оболочке желудка in vitro и рост этих бактерий in vitro. Уменьшение результатов УДТ при назначении L. reuteri, полученное в данном исследовании, может быть объяснено действием на H. pylori реутерина, включая непрямое подавление фиксации H. pylori к слизистой желудка и уменьшение обсемененности H. pylori.
Известно, что инфицирование H. pylori стимулирует слизистую оболочку желудка и лимфоциты, усиливая секрецию цитокинов, таких как интерлейкин-8 (ИЛ-8) и ФНО-α, и вызывает гастрит. Инфицирование H. pylori индуцирует воспаление слизистой желудка, что вызывает гастрит. Обсуждаемые ранее бактерии LG21 способны подавлять выработку ИЛ-8 in vitro. В других отчетах26 указывается, что лактобактерии подавляют данные цитокины и уменьшают выраженность воспалительных заболеваний кишечника и аллергических реакций. Экзогенное введение в организм штамма L. reuteri ATCC 55730 в виде таблеток приводит к выраженной колонизации антрального отдела желудка21 — основного места обитания H. pylori. Следовательно, после назначения пробиотика можно ожидать тесного взаимодействия между L. reuteri и патогенным микроорганизмом in vivo. Данные отчеты рассматривают возможность уменьшения выраженности хеликобактерного гастрита с помощью таблеток, содержащих L. reuteri, за счет подавления цитокинов слизистой оболочки желудка.
Заключение
Применение таблеток, содержащих L. reuteri [Reuterina (ERINA Co.,Inc.)], существенное уменьшает результаты УДТ у субъектов с положительным анализом на H. pylori, что указывает на способность L. reuteri уменьшать обсемененность H. pylori. Существует надежда на то, что таблетки, содержащие L. reuteri, можно будет использовать для предотвращения развития клинических симптомов у лиц с положительным анализом на H. pylori при отсутствии признаков заболевания и для уменьшения выраженности гастрита. Также возможно, что препарат поможет уменьшить выраженность симптомов и гастрита у пациентов, инфицированных H. pylori, которым не помогла эрадикационная терапия.
Благодарность
Мы выражаем благодарность компании ERINA Co.,Inc. за финансовую поддержку данного исследования, а также Anders Zachrisson (компания BioGaia AB) за совет. Кроме этого, мы благодарим участников исследования, без которых проведение данной работы было бы невозможным.
Список литературы:
1. Miwa H, Ohkura R, Murai T, Sato K, Nagahara A, Hirai S, et al.Impact of rabeprazole, a new proton pump in- hibitor, in triple therapy for Helicobacter pylori infection-comparison with omeprazole and lansoprazole. Aliment Pharmacol Ther 1999137416.
2. Asaka M, Sugiyama T, Kato M, Satoh K, Kuwayama H, Fukuda Y, et al.A multicenter, double-blind study on
triple therapy with lansoprazole, amoxicillin and clarithromycin for eradication of Helicobacter pylori in Japanese
peptic ulcer patients. Helicobacter 2001625461.
3. Miwa H, Nagahara A, Sato K, Ohkura R, Murai T, Shimizu H, et al.Efficacy of 1 week omeprazole or
lansoprazole-amoxycillin-clarithromycin therapy for Helicobacter pylori infection in the Japanese population. J Gas-
troenterol Hepatol 19991431721.
4. Miwa H, Ohkura R, Murai T, Nagahara A, Yamada T, Ogihara T, et al.Effectiveness of omeprazole-amoxicillin-
clarithromycin (OAC) therapy for Helicobacter pylori infection in a Japanese population. Helicobacter 19983
1328.
5. Suzuki J, Mine T, Kobayasi I, Fujita TAssessment of a new triple agent regimen for the eradication of Helico-
bacter pylori and the nature of H. pylori resistance to this therapy in Japan. Helicobacter 199835963.
6. Uemura N, Okamoto S, Yamamoto SHelocobacter pylori. Infection and the development of gastric cancer. N
Engl J Med 200134582932.
7. Ohara S, Kato M, Asaka M, Toyota TStudies of 13C-urea breath test for diagnosis of Helicobacter pylori infection in Ja-
pan. J Gastroenterol 199833613.
8. Logan RP, Polson RJ, Misiewicz JJ, Rao G, Karim NQ, Newell D, et al.Simplified single sample 13Carbon urea breath test
for Helicobacter pylori : comparison with histology, culture, and ELISA serology. Gut 19913214614.
9. Graham DY, Klein PD, Evans DJ Jr, Evans DG, Alpert LC, Opekun AR, et al.Campylobacter pylori detected noninvasively
by the 13C-urea breath test. Lancet 19872311747.
10. Takahashi S, Igarashi H, Ishiyama N, Nakano M, Ozaki M, Ito M, et al.Serial change of gastric mucosa after challenging
with Helicobacter pylori in the cynomolgus monkey. Zentralbl Bakteriol 1993280517.
11. Kobayashi D, Eishi Y, Ohkusa T, Ishige I, Suzuki T, Minami J, et al.Gastric mucosal density of Helicobacter pylori esti-
mated by real-time PCR compared with results of urea breath test and histological grading. J Med Microbiol 200251
30511.
12. Chen X, Haruma K, Kamada T, Mihara M, Komoto K, Yoshihara M, et al.Factors that affect results of the 13C urea
breath test in Japanese patients. Helicobacter 2000598103.
13. Hazell SL, Lee ACampylobacter pyloridis, urease, hydrogen ion back diffusion, and gastric ulcers. Lancet 19865157.
14. Thomsen L, Tasman-Jones C, Morris A, Wiggins P, Lee S, Forlong CAmmonia produced by Campylobacter pylori neutral-
izes H+ moving through gastric mucus. Scand J Gastroenterol 1989247618.
15. Chang YW, Min SK, Kim KJ, Han YS, Lee JH, Dong SH, et al.Delta (13)C-urea breath test value is a useful indicator for
Helicobacter pylori eradication in patients with functional dyspepsia. J Gastroenterol Hepatol 20031872631.
16. McGroarty JAProbiotic use of lactobacilli in the human female urogenital tract. FEMS Immunol Med Microbiol 1993
625164.
17. Reid G, Bruce AW, McGroarty JA, Cheng KJ, Costerton JWIs there a role for lactobacilli in prevention of urogenital and
intestinal infections? Clin Microbiol Rev 1990333544.
18. Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga YSuppressive effect of Lactobacillus gasseri OLL 2716 (LG21)
on Helicobacter pylori infection in humans. J Antimicrob Chemother 20014770910.
19. Michetti P, Dorta G, Wiesel PH, Brassart D, Verdu E, Herranz M, et al.Effect of whey-based culture supernatant of Lacto-
bacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans. Digestion 1999602039.
20. Felley CP, Corthesy-Theulaz I, Rivero JL, Sipponen P, Kaufmann M, Bauerfeind P, et al.Favourable effect of an acidified
milk (LC-1) on Helicobacter pylori gastritis in man. Eur J Gastroenterol Hepatol 200113259.
21. Valeur N, Engel P, Carbajal N, Connolly E, Ladefoged KColonization and immunomodulation by Lactobacillus reuteri
ATCC 55730 in the human gastrointestinal tract Appl Environ Microbiol 200470117681.
22. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori HInhibition of binding of Helicobacter pylori to the glycolipid
receptors by probiotic Lactobacillus reuteri. FEMS Immunol Med Microbiol 20023210510.
23. Talarico TL, Casas IA, Chung TC, Dobrogosz WJProduction and isolation of reuterin, a growth inhibitor produced by
Lactobacillus reuteri. Antimicrob Agents Chemother 19883218548.
24. Talarico TL, Dobrogosz WJChemical characterization of an antimicrobial substance produced by Lactobacillus reuteri. An-
timicrob Agents Chemother 1989336749.
25. Johnson C, Dicksved J, Jonsson H, Roos SAnti Helicobacter pylori activity among lactic acid bacteria isolated from gastric
biopsies and strains of Lactobacillus reuteri. Helicobacter 20038473.
26. Wu J, Wang XX, Takasaki M, Ohta A, Higuchi M, Ishimi YCooperative effects of exercise training and genistein admini-
stration on bone mass in ovariectomized mice. J Bone Miner Res 200116182936.
Third Department of Internal Medicine, Kyorin University School of Medicine, 16-20-2 Shinkawa, Mitaka-shi, Tokio 181-861, Japan Kyoto IMASE
